锂离子电池充放电机理及“锂亚原子”模型
摘要:锂离子电池的研究和发展一直都是以“摇椅理论”为指导,由于受该理论的影响,很多现象很难用传统的电化学理论进行解释。作者在生产实践中通过对一些现象的观察,并做了大量的试验和研究,提出“锂亚原子”的模型,并在此模型的基础上,对锂离子电池的充放电反应机理和一些现象用电化学理论进行了解释。
主题词:锂离子电池、反应机理、锂亚原子
一、前言
锂离子电池是在锂金属电池基础上发展起来的。由于锂金属电池在充放电时出现锂枝晶,刺破隔膜造成短路,出现爆炸等现象,这一问题长期困扰锂金属电池的发展,目前仍很难投入到民用市场。锂离子电池研究始于20世纪80年代,1991年首先由日本索尼公司推出了批量民用产品,由于其具有比能量高、体积小、重量轻、工作电压高、无记忆效应、无污染、自放电小等优点,受到市场欢迎,并迅速占领市场,广泛用于移动通讯、笔记本电脑、移动DVD、摄像机、数码相机、蓝牙耳机等便携式电子产品。目前主要产地集中在日本、中国和韩国,预计2004年全球需求量将达到10亿只。

由于锂离子电池从开始研究到现在才20多年时间,真正投入应用也只有十多年的时间,基础理论的研究还不是十分成熟,对锂离子电池的生产和发展很难起到全面指导作用,特别是对电池充放电反应机理的认识还存在很大分歧,有些现象用目前的理论和机理还很难解释。本文对锂离子电池充放电反应机理提出了一些看法,并对生产中存在的现象进行了解释,希望与锂电池同行共同探讨。
二、基本原理
目前锂离子电池公认的基本原理为“摇椅理论”,该理论认为锂离子电池充放电反应机理不是通过传统氧化还原反应来实现电子转移,而是通过锂离子在层状物质的晶格中嵌入和脱出,发生能量变化。
目前锂离子电池正极一般采用LiCOO2,负极为石墨,电解液为LiPF6+EC+DMC。充电时锂离子从正极层状氧化物的晶格间脱出,通过有机电解液迁移到层状负极表面后嵌入到石墨材料晶格中,同时剩余电子从外电路到达负极。放电则相反,锂离子从石墨晶格中脱出回到正极氧化物晶格中。在正常充放电情况下,锂离子在层状结构的石墨和氧化物间的嵌入和脱出一般只引起层间距的变化 ,而不会引起晶体结构的破坏,伴随充放电进行,正负极材料的化学结构基本不发生变化,因此从充放电反应的可逆性来讲,锂离子电池是一种理想的可逆电池。锂离子进入电极过程叫嵌入,从电极中出来的过程叫脱出,在充放电时锂离子在电池正负极中往返的嵌入——— 脱出,正像摇椅子一样在正负极中摇来摇去,故有人将锂离子电池形象的称为“摇椅电池”。
充放电时正负极发生反应为:

三、锂离子电池存在的现象及疑问
(一)荷电态的石墨负极在空气中自燃
将锂离子电池在荷电状态下进行解剖,取出正负极片放在空气中观察,经过几分钟(荷电量多,时间短;荷电量少,时间长)发现负极表面出现白色物质,并伴有气泡产生,极片有发热现象,随后气泡逐渐加剧,严重时出现燃烧。
(二)钴酸锂在空气中长期存放发生变质
正极材料钴酸锂放在NMP和PVDF中搅拌均匀后存放15天,发现钴酸锂变成“豆腐脑状”。如果放在水中搅拌均匀存放,几天时间即出现此现象。用“变质”的钴酸锂制作电池容量很低。
根据摇椅理论,锂在正负极中是以离子状态存在的,应该是非常稳定的,COO2和石墨本身也是非常稳定的物质,很难同空气中的物质发生反应。分析以上两种现象很像是锂同水发生了反应,如果是锂,它又是从何而来,如果锂不是以离子形态在正负极材料中存在,那它又为什么相对稳定呢?看来很难用摇椅理论来解释此现象。为了解释上述现象,本文提出一些新的“观点”,并据此推断锂离子电池充放电反应机理,解释一些锂离子电池存在的现象,供锂电池同行参考。
四、“锂亚原子”形态的存在和充放电反应机 理“假说”
锂在锂离子电池的正负极材料中存在形态不是离子形态,但又不是原子形态,而是介于原子与离子的中间形态,暂定为“锂亚原子”,锂原子核和电子形成一对类似于共价化合物的稳定的化学键,既具有锂离子稳定性,又具有一定的锂原子活性。在没有外界条件激活时是比较稳定的,表现出锂离子性能,一但遇到适合的条件,又可以发生反应,表现出锂原子的性能。“锂亚原子”的活性同电子与原子核距离有关,距离越远,稳定性越好。而锂的电子与原子核距离是由其存在材料属性决定的,COO2和石墨能对锂原子产生强烈作用,使其电子远离原子核形成“锂亚原子”。COO2对锂原子作用比石墨更强,电子与原子核距离更远,因此COO2中的“锂亚原子”比石墨中的“锂亚原子”更稳定。
根据这种假设推断,锂离子电池在充放电过程中应该是“锂亚原子”发生氧化还原反应,而不是锂离子嵌入—— 脱出。
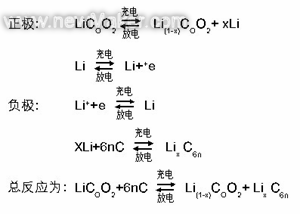
充电时,“锂亚原子”失去电子变成离子后进入溶液,锂离子在电场作用下到达负极,与从外电路过来的电子在石墨的作用下形成“锂亚原子”,存在于负极材料中。放电则相反,“锂亚原子”失去电子变成锂离子进入溶液,在电场作用下迁移到正极,与外电路过来的电子在COO2作用下形成“锂亚原子”存在于正极材料中。充放电时正负极能量变化是由“锂亚原子”得失电子形成的,即在正负极上发生氧化还原反应,只是在两极发生反应为同一种物质。层状物质COO2和石墨(6n个C)能对锂原子产生强烈作用,使电子远离原子核,形成相对稳定类似于共价键化合物的物质LiCOO2和LiC6n。因此,LiCOO2不能叫为钴酸锂,应该叫“锂钴氧化物”更合适,“锂离子电池”名称也不合适,应该叫“锂蓄电池”。
五、分析与讨论
(一)荷电态负极片在空气中自燃现象解释
在充电时,石墨的6n个碳原子对锂原子产生了强烈作用,形成具有稳定化学键的LixC6n化合物,其中Li是以亚原子形态存在,相对比较稳定,因此电池刚解剖时极片没什么反应,由于锂不是离子态,而且碳对其引力也不是很强大,因此仍具有一定活性,可以与空气中水发生反应:
Li+H2O ===== LiOH+H2↑
此反应是放热反应,反应放出热量进一步激活“锂亚原子”,使其具有更高活性,反应进一步加剧,因此存放几分钟后会有气泡产生,并有白色LiOH产生。如果荷电量比较大,“锂亚原子”数量较多,反应量很大,就会产生自燃现象。如果存在Li与H2O反应,应生成强碱性LiOH。用PH纸测试白色物质是为强碱性,而LiPF6电解液为弱酸性,这也进一步证实了LiOH存在。
(二)钴酸锂在空气中长期存放发生变质的解释
锂由于受到氧化钴强烈作用形成“锂亚原子”,氧化钴比石墨对锂的作用更大,因此,锂的电子距离锂原子核更远,更接近于离子态。因此,它是比较稳定,但它毕竟不是离子,还具有一定的活性,长期存放时NMP逐渐吸收空气中水份与“锂亚原子”缓慢发生反应,逐渐发生变化并放出一定热量,豆腐脑状物质就是钴酸锂失去部分锂后和反应生成LiOH的混合物。在水溶液中由于水份充分,反应比在NMP中快。由此引出纯钴酸锂长期在空气中存放也会有部分锂损失,为验证此说法,将钴酸锂在空气中存放1个月后再配料制作电池比容量比正常低5%左右。
(三)锂离子电池过流充电会发生爆炸
锂离子电池充电5倍率以上容易发生爆炸,这主要是锂与石墨中6n个碳形成LiC6n化合物的反应是有一定反应速度的。在小电流充电时,Li++e→Li反应速度比Li+6nC→LiC6n结合速度慢,不会形成锂原子堆积,因此比较安全。在过流(5C以上)时形成锂原子速度会比形成LiC6n速度快,因此会造成锂原子堆积,形成锂枝晶,刺穿隔膜,致使电池内阻短路,电池短路会使放电电流瞬间增加很大,放出大量热量,使电解液分解产生大量气体,内压急剧上升造成电池爆炸。
(四)锂离子电池过热(150℃以上)会发生爆炸
由于锂在氧化钴和石墨中是以亚原子状态存在,在受热条件下其活性大大增加,在超过150℃以上时氧化钴和石墨对锂作用大大减弱,锂的电子与锂原子核距离很近,基本接近或达到锂原子状态,锂原子与电解液能发生反应,产生大量气体,内压迅速上升,造成电池爆炸。
六、结论
(一)氧化钴和石墨等层状物质能对锂原子产生强烈作用,使其变成介于原子和离子状态之间的形态——— 亚原子,锂在氧化钴和石墨中是以亚原子形态存在的,而不是以离子形态存在。
(二)“锂亚原子”的活性同锂原子核与电子之间距离有关,距离越近,活性越高,锂的电子与原子核的距离是由其存在材料属性决定的。
(三)锂离子电池充放电机理也是氧化还原反应,只是正负极参加反应为同一种物质。
(四)钴酸锂应该叫“锂钴氧化物”,锂离子电池应该叫“锂蓄电池”。 (end)

